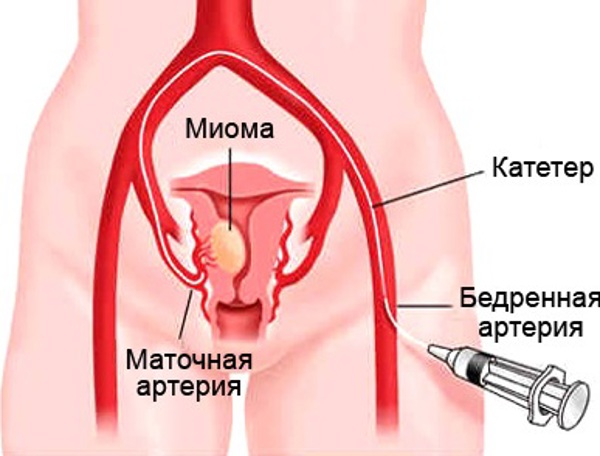
Эмболизация маточных артерий.
В последние годы в клиническую практику вошел относительно новый метод лечения миомы матки – эндоваскулярная эмболизация маточных артерий (ЭМА). Первое сообщение об ЭМА было сделано J.Oliver et al. в 1979 году, который с успехом применил ЭМА в ургентной ситуации для остановки послеродовых и послеоперационных кровотечений. Логическим продолжением этой темы явились работы французского хирурга-гинеколога Jacques Ravina, начавшего в 1991 году выполнять ЭМА в качестве планового предоперационного лечения, направленного на уменьшение кровопотери в ходе гистерэктомии или миомэктомии. Однако подобная тактика привела к парадоксальному эффекту – неожиданно многие женщины после предоперационной ЭМА стали отказываться от хирургического лечения, так как у них пропадали симптомы, связанные с миомой. Причины подобного результата ЭМА были установлены во время контрольных ультразвуковых исследований, показавших резкое уменьшение размеров миоматозных узлов и в целом матки. После первых публикаций, подтвердивших высокую эффективность нового эндоваскулярного метода лечения миом матки, с 1997 года началось стремительное внедрение ЭМА в повседневную клиническую практику. К 2000 году в мире было выполнено уже более 10 000 вмешательств, к 2002 году – более 50 000, а прогнозируемая потребность метода в 2003 году составила 100 000 эмболизаций.
В России ЭМА стала использоваться лишь на протяжении последних 4 -5 лет.
Показания к ЭМА практически неограниченны и включают:
- все «симптомные» миомы, т.е. миомы, вызывающие кровотечения, боли, чувство тяжести, учащенное мочеиспускание, диспареунию и т.д.,
- растущие бессимптомные миомы, независимо от количества узлов, их локализации и размера.
Показания к ЭМА значительно шире показаний для оперативного лечения ММ, и, кроме того, эндоваскулярное вмешательство обеспечивает полноценную органосохраняющую альтернативу гистерэктомии, позволяя избежать наркоза, операционной травмы и серьезных осложнений, возможных как в раннем, так и в отдаленном послеоперационном периодах после хирургического лечения.
Особо стоит отметить использование ЭМА у женщин, имеющих желание сохранить или восстановить способность к деторождению. Вероятность наступления беременности после ЭМА сопоставима с аналогичным показателем после миомэктомии. Более того, в группе больных, у которых выполнение миомэктомии невозможно или сопряжено с высоким риском перехода в гистерэктомию, ЭМА представляет собой последний шанс сохранить способность к деторождению.
Спектр противопоказаний к ЭМА крайне ограничен и включает в основном злокачественные процессы органов гениталий, активный инфекционный процесс, непереносимость йодсодержащих контрастных веществ.
Анатомия маточных артерий хорошо известна. В большинстве случаев они отходят от передней ветви внутренней подвздошной артерии и являются сосудами четвертого порядка. К основным разветвлениям маточной артерии относятся (в порядке отхождения):
- ветвь, кровоснабжающая дистальную часть уретры;
- цервико-вагинальная ветвь;
- интрамуральные ветви, кровоснабжающие миометрий;
- конечные фундальные ветви, идущие к дну матки;
- медиальные тубальные и яичниковые ветви.
Однако строение маточных артерий отличается большой вариабельностью в которых выделяют 4 различных типа кровоснабжения матки. Эти анатомические особенности оказывают влияние на выбор техники и тактики выполнения ЭМА, предусматривая селективную или суперселективную катетеризацию и эмболизацию ветвей маточной артерии, что способствует лишь локальному прекращению кровотока в патологическом очаге и не сопровождается риском ишемизации близлежащих органов.
Изменения ангиоархитектоники, связанные с ММ, тщательно изучены. Миоматозный узел имеет довольно скудное кровоснабжение, питающие миому артерии практически не анастомозируют с другими сосудами и являются конечными ветвями. Несмотря на то, что вокруг миомы обычно имеется участок повышенной васкуляризации – так называемое перифиброидное сосудистое сплетение, оно имеет аналогичное концевое строение периферических разветвлений. В противоположность этому кровообращение неизмененного миометрия получает снабжение из нескольких артерий и имеет хорошо развитые коллатеральной сети. Именно на этих особенностях кровоснабжения и основан патогенетический механизм ЭМА.
Селективное закрытие сосудов миоматозного узла и перифиброидного сплетения приводит к селективной ишемизации и в дальнейшем к дегенерации только самой миомы, практически не отражаясь на кровоснабжении непораженных участков стенки матки.
Техника эмболизации.
Предоперационная подготовка к ЭМА традиционна для любого эндоваскулярного вмешательства и, как правило, включает назначение седативных и обезболивающих препаратов, превентивной антибактериальной терапии, катетеризации мочевого пузыря.
Техника самого вмешательства заключается в следующем. Поскольку ММ, также как и сам орган, получают симметричное кровоснабжение из обеих внутренних подвздошных артерий, для эндоваскулярного лечения заболевания, независимо от размера и локализации узлов, большинство авторов рекомендуют использовать двухстороннюю ЭМА.
Для селективной катетеризации маточных артерий применяют стандартные катетеры конфигурации «Cobra» или катетер «Levin» диаметром 4-5 F (1,3-1,6 мм). В редких случаях, при трудном для катетеризации отхождении маточной артерии, рекомендуется использовать специальные коаксиальные микрокатетеры «Terumo» малого диаметра 3 F (0,9 мм). Применение таких катетеров способствует снижению продолжительности процедуры, уменьшению риска развития спазма маточной артерии, однако в конечном итоге значительно увеличивает стоимость самого вмешательства за счет использования более дорогих инструментов.
В качестве стандартного доступа для ЭМА чаще всего используют пункцию, катетеризацию и установку интродьюсера в правую общую бедренную артерию по общепринятой методике Сельдингера.
Первоначально производят установку катетера в контрлатеральной внутренней подвздошной и затем маточной артерии, методика которой хорошо известна. Однако для ипсилатеральной катетеризации сосуда требуется использование специфической техники вмешательства. Для этого в аорте катетером формируется петля Волтмана, после чего он низводится во внутреннюю подвздошную артерию на стороне доступа и затем устанавливается в маточной артерии. R.Shlansky-Goldberg et al. предложил использовать модифицированную технику Коупа для формирования петли, устраняющей некоторые трудности при суперселективной катетеризации. С целью уменьшения описанных технических проблем, а также для ускорения вмешательства и снижения облучения B.Nikolic использовал одновременный стандартный двусторонний доступ через обе бедренные артерии. Однако, по мнению автора, такой подход пропорционально увеличил и риск развития локальных осложнений вмешательства.
Рисунок. Схема техники ЭМА.
Эмболизационные препараты.
Поскольку главной целью вмешательства является эмболизация артерий миоматозного узла и перифиброидного сплетения, сосуды которых имеют средний диаметр не более 500 нм, для ЭМА применяются синтетические гидрогели соответствующего размера. Для их изготовления чаще всего используют сухие частицы поливинилалкоголя (ПВА), диаметром 500-710 нм, в редких случаях - 355-500 нм или 150-355 нм, которые пропорционально разводят в смеси контрастного вещества и изотонического раствора до достижения равномерной взвеси препарата непосредственно перед вмешательством.
В последние годы для ЭМА ряд авторов стали применять гидрофильные эмбосферы, обосновывая свой выбор тем, что эти гранулы менее склонны к слипанию, чем частицы ПВА, проникают дистальнее за счет правильной формы и гидрофильного покрытия, и тем самым обеспечивают большую эффективность вмешательства. В литературе также имеются сообщения об использовании для ЭМА и других веществ, таких как Gelfoam и липоидол.
Выбор для ЭМА тех или иных препаратов, а зависимости от их технической характеристики, во многом влияет и на правильную технику самого вмешательства. При использовании частиц ПВА большинство авторов рекомендуют выполнять эмболизацию до остановки кровотока в стволе маточной артерии. При применении эмбосфер придерживаются менее агрессивного подхода – эмболизируют до появления симптома «обгорелого дерева» и лишь замедления кровотока в маточной артерии.
На ранних этапах применения ЭМА некоторые исследователи завершали вмешательство установкой эмболизационных спиралей в дистальный отдел маточной артерии. Однако вскоре от этой практики большинство авторов отказались, так как никакого дополнительного положительного эффекта такая тактика не давала, а лишь затрудняла развитие коллатералей в здоровом миометрии.
Послеоперационный период после ЭМА.
Ближайший послеоперационный период у больных, перенесших ЭМА по поводу миомы матки, сопровождается своеобразной клинической картиной, так называемым «постэмболизационным синдромом», характерным при эмболизации других внутренних органов, котрый включает в себя:
- болевой синдром;
- метроррагию;
- гипертермию;
- лейкоцитоз;
- дизурию;
- нарушения со стороны желудочно-кишечного тракта;
- нарушения со стороны сердечно-сосудистой системы;
- нарушения гемостаза.
Для пациенток, перенесших ЭМА, в раннем постэмболизационном периоде характерны боли в нижних отделах живота. Выраженность и продолжительность болевого синдрома зависят от размеров узлов, от расположения узлов по отношению к различным отделам матки (дно, перешеек, шейка) и не зависят от направления роста узлов (подслизистые, подбрюшинные, межмышечные). Наибольшая интенсивность болевого синдрома отмечается при больших размерах матки, а также при перешеечном расположении миоматозных узлов диаметром 7-10 см и при диаметре >15 см миоматозных узлов любой локализации, прошедших ЭМА. Умеренно выраженный болевой синдром диагностируется у пациенток с единичными миомами малых размеров (до 6 – 7 см в диаметре), и при наличии дополнительных источников кровоснабжения узлов (маточно-яичниковые артериальные анастомозы) – у которым ЭМА произведена по поводу маленьких размеров миом около 2 – 3 см, независимо от их количества, а так же при выполнении ЭМА лишь с одной стороны, после ЭМА отмечался невыраженный болевой синдром. Наиболее выраженные болевые ощущения характерны через 4-6 часов после ЭМА, которые сохранялись в течение суток.
Появление болевого синдрома объясняется не только и не столько ишемизацией узла, а в основном прекращением и/или снижением кровотока в сосудах неизмененного миометрия, что доказывается результатами, полученными при допплерометрии кровотока в миометрии до, в первые часы и сутки после ЭМА.
Исследование показателей регионарного кровообращения, преимущественно радиальных ветвей маточных артерий, т.е. сосудов перинодулярной и интранодулярной областей, показало отсутствие кровотока сразу после ЭМА и в течение всего периода наблюдения.
ЭМА приводит к выраженной ишемии матки и миомы, которая по отношению к неизмененным слоям органа носит транзиторный характер. Согласно проведенным ранее исследованиям в миоматозных узлах не обнаруживаются холин- и адренергические нервные структуры, поэтому болевой синдром обусловлен, прежде всего, острой ишемией миометрия и эндометрия.
Несмотря на выраженность болевой реакции, болезненность узлов при пальпации, ни в одном случае не возникает симптомов раздражения брюшины и развития, так называемого «острого» живота, требующего экстренного оперативного вмешательства.
Другим из наиболее значимых симптомов постэмболизационного синдрома, сопровождающего ЭМА, являются кровяные выделения из половых путей, которые имеют скудный или умеренный характер. Для этой категории пациенток характерны преимущественно интерстициальные или интерстициально-субмукозно расположенные миоматозные узлы.
Появление кровяных выделений определяют механизмы:
- в результате острой закупорки маточных артерий возникает транзиторная ишемия непораженного миометрия, что провоцирует десквамацию эндометрия и сопровождается эффектом аналогичным менструации. Эти данные подтверждены при допплерометрии.
- острая ишемия миоматозного узла, особенно при его субмукозном и субмукозно-интерстициальном расположении, приводит к некротизации и отторжению его частей в полость матки.
По данным допплерометрии кровоток в эндометрии изменяется параллельно с кровотоком в миометрии. В первые часы после манипуляции отмечается резкое снижение кровотока, затем медленное восстановление его через 3-4 дня. К концу 1-х, в начале 2-х суток обычно наблюдалось появление кровяных выделений.
Примерные сроки госпитализации для проведения эмболизации маточных артерий 2-3 дня.
Планировать беременность можно через 6 -12 месяцев после процедуры.