В работе представлен анализ результатов клинического применения эзофагогастропластики с формированием антирефлюксного пищеводно-желудочного анастомоза трансхиатальным доступом при лечении 11 больных с доброкачественными стенозирующими поражениями дистального отдела пищевода. Летальных исходов и специфических послеоперационных осложнений отмечено не было. Результаты обследований, проведенных в ранний и отдаленный послеоперационный период, свидетельствуют, что жомно-клапанный эзофагогастроанастомоз функционально активен, надежно препятствует развитию гастроэзофагеального рефлюкса и является залогом высокого уровня качества жизни больных после дистальной резекции пищевода с первичной эзофагогастропластикой.
Из радикальных оперативных пособий, используемых при доброкачественных стенозирующих поражениях дистального отдела пищевода, наиболее распространенной в настоящее время является резекция пищевода с одномоментной эзофагогастропластикой. При этом технически сложные этапы хирургического вмешательства на пищеводе и желудке сопряжены с необходимостью выполнения комбинации широкой лапаро- и торакотомии, что обусловливает значительную травматичность операции и, как следствие, сохранение высоких цифр ранних послеоперационных осложнений и летальности [3, 8].
Использование широкой сагиттальной диафрагмокруротомии позволяет проводить мобилизацию и резекцию нижнегрудного отдела пищевода под визуальным контролем с последующим формированием эзофагогастроанастомоза трансхиатальным доступом, что, несомненно, уменьшает тяжесть операции и продолжительность послеоперационной реабилитации больных. Однако большинство хирургов отмечает неудовлетворенность отдаленными функциональными результатами пластического замещения пищевода, которая продиктована развитием более чем у половины всех оперированных больных патологических состояний, вызванных гастроэзофагеальным рефлюксом [1, 2, 5, 10].
Среди послеоперационных регургитационных осложнений наиболее часто встречаются рефлюкс-эзофагит культи пищевода, стенозирование эзофагогастроанастомоза, пищевод Барретта, рак пищевода, аспирационный бронхит и пневмонии, приводящие к инвалидизации больных и зачастую к повторным реконструктивным операциям [1, 9]. По мнению А.Ф. Черноусова (1998), актуальность проблемы рефлюкс-эзофагита после эзофагогастропластики связана, прежде всего, с утратой сдерживающего механизма нижнего пищеводного сфинктера [6]. Сохранить антирефлюксную функцию физиологической кардии после дистальной резекции пищевода возможно путем создания функционально активного эзофагогастроанастомоза, препятствующего забросу желудочного содержимого в культю пищевода. Однако формирование подавляющего большинства соустий, призванных обеспечить профилактику послеоперационного рефлюкс-эзофагита, технически возможно только из широкого трансплеврального доступа [4, 5, 7, 10].
Таким образом, в настоящее время проблема поиска надежного трансхиатального способа профилактики регургитационных осложнений, способного обеспечить высокий уровень качества жизни данной категории больных, является актуальной и требует проведения дальнейших клинических исследований.
Цель работы
Улучшить функциональные результаты дистальной резекции пищевода путем формирования антирефлюксного эзофагогастроанастомоза трансхиатальным доступом.
Материалы и методы
В настоящее исследование включены 11 больных с доброкачественными стенозирующими поражениями дистальной части пищевода (8 мужчин и 3 женщины). Средний возраст составил 51,2±3,7 лет. Объем предоперационной диагностики включал оценку клинических и лабораторных критериев, эндоскопическое исследование и изучение моторно-эвакуаторной функции верхних отделов желудочно-кишечного тракта в ходе полипозиционной рентгеноскопии, манометрии, рН-метрии, эндоскопической и трансабдоминальной ультрасонографии эзофагогастродуоденального комплекса.
Основными показаниями к выполнению радикальных операций на дистальном отделе пищевода считали фиброзирующее поражение всех слоев его стенки (по данным эндоскопического ультразвукового исследования), невозможность расширения стриктуры, быстрые и частые рецидивы после дилатации, наличие очагов метаплазии эпителия в зоне стеноза (пищевод Барретта), подозрение на малигнизацию – дисплазия высокой степени (карцинома in situ).
Основой для выбора способа профилактики послеоперационных рефлюксных осложнений явились работы проф. Г.К. Жерлова по формированию функционально активных жомно-клапанных соустий [3]. Обследование больных в ранний и отдаленный послеоперационный период включало оценку клинических критериев, проведение рентгенологического и эндоскопического исследований верхних отделов желудочно-кишечного тракта, проведение морфологических исследований слизистой оболочки культи пищевода, зоны анастомоза и желудочного трансплантанта. Определение уровня качества жизни больных оценивали с помощью специализированного опросника Gastrointestinal Quality of Life Index (E. Eypasch, 1995) с расчетом гастроинтестинального индекса.
Результаты и обсуждение
Показаниями для выполнения резекции дистального отдела пищевода у 9 (81,8%) больных послужила пептическая стриктура последнего, у 2 (18,2%) – пищевод Барретта. При этом у 10 (90,9%) обследованных была диагностирована аксиальная грыжа пищеводного отверстия диафрагмы, в 5 случаях сочетающаяся с приобретенным коротким пищеводом (рис. 1). Результатом прогрессирования рефлюксной болезни верхних отделов желудочно-кишечного тракта явилось также развитие внепищеводных осложнений, таких как регургитационная бронхолегочная патология (3) и кардиалгии (2). Следует отметить, что 6 (54,5%) больным ранее применяли неоднократное бужирование и эндоскопическую дилатацию зоны пищеводной стриктуры. У одного больного случайной находкой в препарате резецированного пищевода явилась распространенная дисплазия многослойного плоского эпителия разной степени тяжести с участками карциномы in situ.
Таким образом, анализируя причины развития стенотических, воспалительно-эрозивных и неопластических изменений дистального отдела пищевода, явившихся показанием к оперативному лечению, следует вести речь об осложненном течении гастроэзофагеальной рефлюксной болезни, развитие которой в подавляющем большинстве случаев было обусловлено наличием аксиальной грыжи пищеводного отверстия диафрагмы. С целью профилактики послеоперационного гастроэзофагеального рефлюкса и связанных с ним осложнений нами был использован способ формирования антирефлюксного эзофагогастроанастомоза, разработанный ранее для субтотальных резекций пищевода с одномоментной эзофагогастропластикой из абдоминоцервикального доступа (Патент №2143849 от 10.01.2000.) [2].
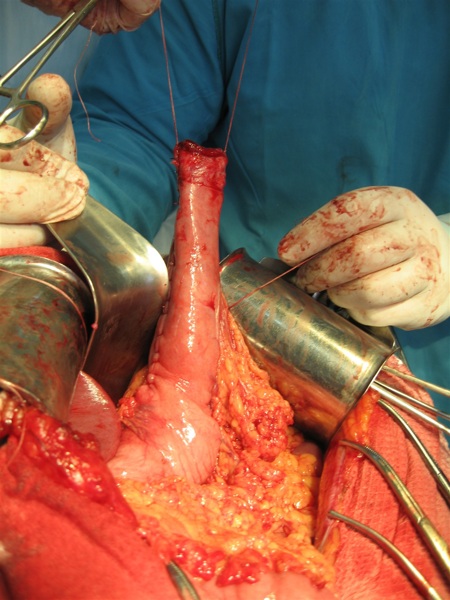
Для создания широкого доступа к нижнегрудному отделу пищевода в заднем средостении выполняли верхнесрединную лапаротомию в положении больного с подложенным под спину валиком на уровне мечевидного отростка, использовали подъемники реберных дуг М.З. Сигала. Проводили мобилизацию левой доли печени, сагиттальную диафрагмокруротомию по А.Г. Савиных, тупо отслаивая перикард от диафрагмы. Пищевод мобилизовали и резецировали в пределах здоровых тканей на уровне его супрастенотического расширения. Контроль уровня резекции осуществляли посредством проведения интраоперационной эзофагоскопии. На дистальном отделе культи пищевода путем рассечения соединительнотканных волокон между мышечной оболочкой и подслизистым слоем циркулярно отсепаровывали мышечную оболочку шириной до 10-12 мм, которую заворачивали кверху и подшивали свободным краем к мышечной оболочке культи пищевода в состоянии умеренного натяжения.
Далее из большой кривизны желудка формировали конусовидную трубку шириной 25-30 мм с сохранением правой и левой желудочно-сальниковых артерий (до дистальных коротких желудочных сосудов), при этом резецировали дно и малую кривизну желудка выше его угла. На проксимальном конце желудочного стебля рассекали, отсепаровывали и удаляли по всей окружности полоску серозно-мышечной оболочки шириной 18-20 мм (рис. 2).
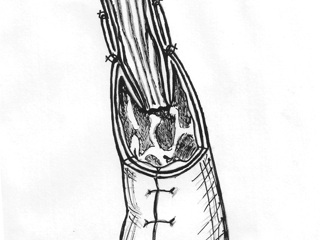
Сформированный желудочный трансплантат проводили в заднем средостении к культе пищевода и анастомозировали трансхиатально двухрядным швом: первый ряд – узловые швы, проходящие через заднюю полуокружность нижнего края жома культи пищевода и край серозно-мышечной оболочки желудочного стебля; второй ряд – непрерывный шов (Викрил №000 на атравматической игле) на подслизистые слои анастомозируемых органов, отступя от первого ряда швов на 18-20 мм. Затем на переднюю полуокружность анастомоза накладывали второй ряд швов и одновременно с помощью диссектора избыток слизисто-подслизистых слоев погружали в просвет желудочного трансплантата, формируя инвагинационный клапан (рис. 3).
Следует отметить, что принцип послойного сшивания анастомозируемых органов с удалением друг от друга на 18-20 мм первого и второго ряда швов позволил осуществлять наложение наиболее ответственного – подслизисто-подслизистого шва не в глубине заднего средостения, а в более комфортных для хирурга условиях – на уровне диафрагмотомического отверстия, что обеспечило во всех случаях возможность формирования «высокого» анастомоза трансхиатальным доступом и явилось залогом его состоятельности в послеоперационном периоде.
Низведение сформированного соустья в брюшную полость, диафрагмокрурорафию и пилоропластику не проводили по принципиальным позициям ни у одного больного. Операцию заканчивали установкой назогастрального зонда (для декомпрессии верхних отделов желудочно-кишечного тракта на протяжении 2-3 суток) и назоеюнального микрозонда (с целью проведения энтерального питания в течение первых 3-4 суток послеоперационного периода), кроме того осуществляли трансхиатальное дренирование заднего средостения силиконовым дренажом, установленным через отдельный прокол в левом подреберье. Лапаротомную рану ушивали послойно.
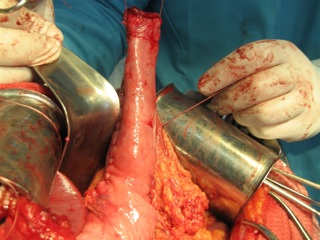
Анализируя результаты клинического применения разработанной операции, следует подчеркнуть, что летальных исходов и осложнений раннего послеоперационного периода, связанных с несостоятельностью пищеводно-желудочного анастомоза, в наших наблюдениях не было. У 7 (63,6%) больных на протяжении 7-10 дней отмечена транзиторная дисфагия вследствие отека слизистой оболочки инвагинационного клапана в зоне сформированного соустья, а также в результате угнетения перистальтической активности культи пищевода и желудочного трансплантата в ранние сроки после операции (рис. 4). Осложнения общехирургического характера возникли у одного больного (9%) и были связаны с развитием двусторонней пневмонии, что послужило поводом к задержке выписки из стационара. Послеоперационный койко-день составил 12,7±2,3.
При обследовании больных в ближайший и отдаленный послеоперационный период регистрировалось значительное повышение уровня качества жизни по сравнению с дооперационными показателями гастроинтестинального индекса, в частности, по таким шкалам опросника как «общее субъективное восприятие здоровья», «физическое состояние», «социальное и ролевое функционирование». Отличные и хорошие функциональные результаты лечения были отмечены у 8 (72,7%) больных, удовлетворительные результаты связаны с развитием у 2 обследованных постваготомической диареи легкой степени тяжести и у одного – транзиторной дисфагии на фоне психоэмоциональной лабильности.
Для объективной оценки функциональных результатов хирургического лечения клинические данные дополнены проведением исследований, направленных на изучение моторно-эвакуаторной функции желудочного трансплантата, выявление желудочно-пищеводного рефлюкса и патологических изменений, связанных с ним.
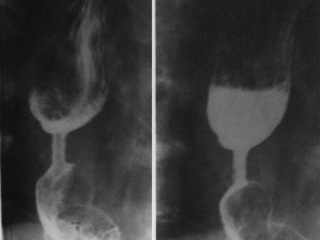
Данные рентгеноскопических исследований верхних отделов желудочно-кишечного тракта оперированных свидетельствовали о том, что сформированный в области соустья арефлюксный механизм не затрудняет эвакуации содержимого пищевода в желудок (максимальное раскрытие анастомотического кольца до 25 мм). У всех больных в зоне анастомоза в просвете желудочного стебля четко визуализировались створки инвагинационного клапана, которые при возникновении эпизодов антиперистальтических сокращений трансплантата плотно смыкались, перекрывая просвет соустья, в полной мере препятствуя забросу желудочного содержимого в пищевод (рис. 5).
При визуальной оценке эзофагогастродуоденального комплекса во всех случаях культя пищевода и ее анастомоз с трансплантантом свободно проходимы, слизистая пищевода не изменена. Створки инвагинационного клапана определялись в виде циркулярной складки слизистой бледно-розовой окраски, без признаков воспаления. Анастомоз сомкнут, раскрывается только при инсуфляции воздуха, активно смыкается на выходе. Зияние привратника с визуализацией признаков дуоденогастрального рефлюкса, а также изменения в слизистой желудка по типу поверхностного гастрита отмечены у 3 (27,3%) больных. При гистологическом исследовании биопсийного материала со слизистой культи пищевода, зоны анастомоза и желудочного стебля – выраженных воспалительных и атрофических изменений не выявлено.
Таким образом, результаты проведенного обследования оперированных больных подтвердили надежность арефлюксной функции сформированного эзофагогастроанастомоза. Несмотря на отсутствие статистической достоверности, тенденция к улучшению отдаленных результатов в плане профилактики рефлюкс-эзофагита после дистальной резекции пищевода с первичной эзофагогастропластикой не вызывает сомнения.
Заключение
Резекция дистального отдела пищевода с формированием антирефлюксного эзофагогастроанастомоза трансхиатальным доступом позволяет не только избежать послеоперационных осложнений, связанных с несостоятельностью соустья, но значительно уменьшает тяжесть операционной травмы, а следовательно, и продолжительность реабилитационного периода. Использование методов функциональной хирургии при выполнении радикальных операций по поводу доброкачественных стенозирующих поражений дистального отдела пищевода обеспечивает надежную профилактику регургитационных осложнений и, в конечном итоге, улучшает качество жизни данной категории больных.
Литература
- Алиев М.А., Баймаханов Б.Б., Жураев Ш.Ш. и др. Реконструктивно-восстановительные операции на пищеводе при послеожоговых рубцовых стриктурах // Хирургия, –2005. –№12. –С.40-43.
- Жерлов Г.К., Гибадулин Н.В., Алипов В.В. Вариант функционально ак-тивного шейного эзофагога¬строанастомоза в хирургии стенозирующих поражений пищевода // Вестник хирургии им. И.И. Гре¬кова. –2001. –№3. –С.39-42.
- Жерлов Г.К. Основы функциональной хирургической гастроэнтерологии: практическое руководство для врачей. –Томск, 2009. –274с.
- Кавайкин А.Г., Чичеватов Д.А., Горшенев А.Н. Прогноз и профилактика несостоятельности анастомозов при эзофагопластике // Хирургия. –2009. –№11. –С.31-33.
- Сидоренко Ю.С., Касаткин В.Ф. Патогенетический подход к профилактике и лечению несостоятельности пищеводных анастомозов // Хирургия. –2009. –№1. –С.25-28.
- Черноусов А.Ф., Андрианов В.А., Домрачев С.А., Богопольский П.М. Опыт 1100 пластик пищевода // Хирургия. –1998. –№6. –С.21-25.
- Черноусов А.Ф., Ручкин Д.В., Черноусов Ф.А., Балалыкин Д.А. Болезни искусственного пищевода. –Москва, 2008. –673с.
- Шипулин П.П., Мартынюк В.А., Байдан В.В., Сажиенко В.В. Сравнительная оценка различных способов эзофагогастропластики // Хирургия. –2005. –№12. –С.36-39.
- Rocha J.R.M., Cecconello I., Felix V.N. et al. Predictive factors of carcinoma development after esophagectomy and cervical gastroplasty in patients with chagasic achalasia: Ten years of follow-up // Diseases of the Esophagus. –2004. Vol.17, Suppl.1. –P.70.
- Schettini S.T., Pinus J. Gastric-tube esophagoplasty in children // Pediatr. Surg. Int. –1998. Vol.14. –P.144-150.
30 января 2013 г.
Ещё больше полезной информации на нашем Телеграм-канале