Фибрилляция предсердий (ФП) и трепетание предсердий (ТП) - нередко объединяются термином "мерцательная аритмия" так как обе эти аритмии имеют схожие этиологические факторы, патогенетические механизмы и нередко встречаются у одних и тех же больных. Тем не менее, ФП и ТП представляют собой две отдельные нозологические формы, каждая из которых имеет свои специфические подходы по диагностике и лечению. Встречающийся в клинической практике термин "мерцание-трепетание предсердий" неправомочен. При сочетании ФП и ТП в диагнозе необходимо отдельно указывать обе формы аритмии.
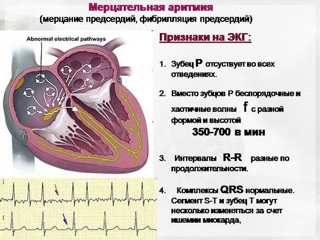
Фибрилляция предсердий представляет собой наджелудочковую тахиаритмию, характеризующуюся, хаотическим, нескоординированным сокращением отдельных мышечных волокон предсердий с частотой от 350 до 700 в минуту, которое сопровождается снижением сократительной способности предсердий и приводит к неправильному и, как правило, учащённому ритму сокращения желудочков (при условии отсутствия полной АВ-блокады).
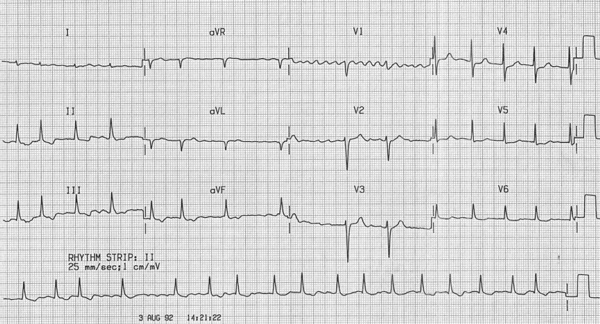
1. Фибрилляция предсердий (рис. 1)
Характерными ЭКГ-признаками ФП являются: отсутствие зубцов Р, наличие разноамплитудных, полиморфных волн ff, переходящих одна в другую без четкой изолинии между ними, а также абсолютная хаотичность и нерегулярность ритма желудочков. Последний признак не регистрируется в случаях сочетания ФП и АВ-блокады III степени (при т. н. феномене Фредерика). (рис. 2)
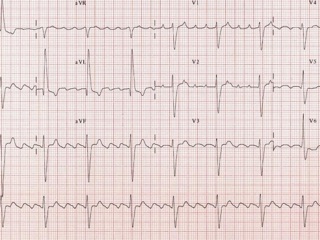
В отличие от ФП, при которой нет эффективного сокращения, ТП сопровождается регулярным и координированным возбуждением миокарда предсердий и их активной систолой. Трепетание предсердий относится к предсердным тахикардиям, обусловленным циркуляцией волны возбуждения по топографически обширному контуру (т. н. "макро-реэнтри"), как правило, вокруг крупных анатомических структур в правом или левом предсердии. По ЭКГ ТП представляет собой правильный высокоамплитудный предсердный ритм с высокой частотой (обычно от 250 до 400 в минуту) и отсутствием четкой изоэлектрической линии между предсердными комплексами (волнами F) хотя бы в одном отведении ЭКГ. Волны F при ТП чаще всего имеют т. н. пилообразный характер хотя бы в одном отведении ЭКГ.
2. Трепетание предсердий (рис. 3)
Впервые описания фибрилляции предсердий у человека, в т. ч. диагностированной с помощью ЭКГ, относят к началу 20-го века (A. Gushny, C. Edmunds, 1906 г. ; C. Rothberder, H. Winterberg, 1909 г. ). Электрокардиографическая характеристика ТП и его дифференциальная диагностика с ФП впервые описаны в 1911 г. Jolly W. и Ritchie W., а Lewis T. с коллегами в 1913 г. первыми выдвинули предположение, что механизм развития данной аритмии связан с циркуляцией волны возбуждения в правом предсердии.
Фибрилляции предсердий является самой распространенной тахиаритмией, выявляемость которой в общей популяции составляет 1-2% и этот показатель, вероятно, увеличится в ближайшие 50 лет. Фибрилляции предсердий может долгое время оставаться не диагностированной (бессимптомная фибрилляции предсердий), а многие больные с фибрилляции предсердий никогда не госпитализируются в стационар. Распространенность фибрилляции предсердий увеличивается с возрастом – от <0, 5% в возрасте 40-50 лет до 5-15% в возрасте 80 лет. У мужчин фибрилляции предсердий развивается чаще, чем у женщин. Риск развития фибрилляции предсердий на протяжении жизни составляет около 25% в возрасте после 40 лет. Эпидемиологические исследования свидетельствуют, что ТП встречается существенно реже, чем ФП: не более 0, 09% в общей популяции. При этом у 58% больных с ТП регистрируется также ФП, а изолированное ТП отмечается только в 0, 037% случаев. Выявляемость ТП, по разным данным, в 2-5 раз выше у мужчин, чем у женщин, как и при ФП. Но при этом женщины чаще подвержены инсультам, имеют большее количество сопутствующих болезней и ярко выраженную клинику ФП.
Несмотря на значимый прогресс в лечении данного заболевания, оно остается одной из основных причин инсульта, сердечной недостаточности, внезапной смерти и сердечно-сосудистой заболеваемости в мире. При этом прогнозируется увеличение числа таких пациентов. Последнее связано с ростом продолжительности жизни и, соответственно, количества пожилых людей, страдающих аритмией.
Сердечно-сосудистая заболеваемость и смертность, ассоциированные с ФП
Событие Ассоциация с ФП
События | Изменение риска у больных с ФП |
Смерть | Повышение смертности, особенно сердечно-сосудистой вследствие внезапной смерти, сердечной недостаточности или инсульта. ФП независимо ассоциируется с двукратным повышением риска смерти от всех причин у женщин и 1, 5-кратным увеличением среди мужчин |
Инсульт (включая геморрагический инсульт и внутричерепное кровотечение) | 20-30% всех инсультов связаны с ФП. Увеличивается количество пациентов с инсультом, у которых диагностируется асимптомная ФП |
Госпитализации | Ежегодно госпитализируется от 10 до 40% пациентов с ФП |
Качество жизни и переносимость физической нагрузки | Качество жизни пациентов с ФП снижается независимо от наличия другой сердечно-сосудистой патологии |
Функция левого желудочка и сердечная недостаточность | Дисфункция левого желудочка обнаруживается у 20-30% пациентов с ФП. У многих пациентов ФП нарушает или ухудшает насосную функцию ЛЖ. В то же время у некоторых пациентов, даже длительно персистирующая ФП не влияет на сократимость ЛЖ |
Когнитивные нарушения и сосудистая деменция | Когнитивные нарушения и сосудистая деменция могут возникнуть даже у пациентов, получающих антикоагулянтную терапию. У пациентов с ФП очаги в белом веществе головного мозга встречаются чаще, чем у людей без ФП. |
Патофизиологические аспекты: В основе возникновения ТП и ФП лежат сходные причины и механизмы. Большинство этих пациентов имеют те или иные заболевания сердечно-сосудистой системы, а именно: гипертоническая болезнь, ИБС, первичные заболевания миокарда, врожденные и приобретенные пороки сердца, синдром Вольфа-Паркинсона-Уайта (ВПУ) или генетическую предрасположенность к аритмиям. Наиболее частыми внесердечными причинами возникновения ФП и ТП являются: гипертиреоз, феохромоцитома, сахарный диабет, злоупотребление алкоголем, избыточная масса тела, апноэ сна и гипокалиемия. Отдельно выделяют ФП/ТП, связанные с поражением сердечных клапанов (чаще - ревматический стеноз митрального клапана или протез митрального клапана, реже - поражение трикуспидального клапана), т. н. "клапанную" мерцательную аритмию. Приблизительно в 30% случаев ФП даже при тщательном клинико-инструментальном обследовании не удается выявить каких-либо кардиальных или несердечных факторов развития аритмии - идиопатическая форма. В противоположность этому, ТП у относительно здоровых людей практически не встречается.
Причины фибрилляции предсердия - Диабет, СН, Ожирение, ИБС, WPW-синдром, Пороки сердца и крупных сосудов, АГ, Старение, генетическая предрасположенность, ХБП
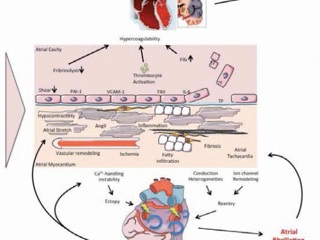
(рис. 4)
Основные механизмы развития фибрилляции предсердий, которые следует учитывать при выборе терапии. Различные этиологические факторы (диабет, СН, ожирение, ИБС, АГ, старение, генетическая предрасположенность, ХБП) вызывают комплекс патофизиологических изменений в предсердиях, включая формирование фиброза в ответ на растяжение камер, жировую инфильтрацию, воспаление, сосудистое ремоделирование, ишемию, дисфункцию ионных каналов и нарушения транспорта ионов Сa2+. Эти изменения усиливают как эктопическую активность, так и нарушения проводимости, способствуя развитию или поддержанию ФП. В то же время некоторые из этих изменений связаны с возникновением состояния гиперкоагуляции на фоне ФП. К примеру, снижение сократительной способности уменьшает локальное напряжение сдвига эндотелия, которое увеличивает экспрессию PAI-1. В свою очередь, воспаление, индуцированное ишемией, усиливает экспрессию молекул адгезии эндотелия или способствует деструктуризации эндотелиальных клеток, что приводит к воздействию тканевого фактора на кровоток. Эти изменения вносят вклад в формирование гиперкоагуляции в полости предсердий при ФП. Кроме того, ФП самостоятельно может ускорять и поддерживать многие из перечисленных патофизиологических механизмов, что во многом объясняет прогрессирующий характер течения аритмии.
Сокращения: ИБС — ишемическая болезнь сердца, СН — сердечная недостаточность, ХБП - хроническая болезнь почек, ФП — фибрилляция предсердий, PAI-1 — ингибитор активатора плазминогена 1.
Ремоделирование ткани предсердий и аритмогенный субстрат
Многие сопутствующие факторы (структурная патология сердца, АГ, СД), а также, главным образом, сама ФП, как видно, способствуют медленному, но непрерывному прогрессированию структурного ремоделирования ткани предсердий. Отличительной чертой процесса является активация фибробластов, усиленное формирование соединительной ткани и прогрессирование фиброза. Кроме того, у пациентов с ФП и коморбидными состояниями, предрасполагающими к ее развитию, может выявляться жировая инфильтрация клеток ткани предсердий, воспалительная инфильтрация, гипертрофия кардиомиоцитов, некроз и амилоидоз. Структурное ремоделирование также приводит к электрической диссоциации кардиомиоцитов и локальными нарушениям проведения, что благоприятствует закреплению и поддержанию аритмии. Причиной феномена электрического ремоделирования предсердий, по-видимому, является возрастание содержания внутриклеточного кальция, приводящее к редукции кальциевого тока, продолжительности потенциала действия кардиомиоцитов и укорочению рефрактерности предсердий. Все это создает субстрат для сохранения аритмии, способствует устойчивости ФП и уменьшению возможности ее спонтанного прекращения, а также уменьшению эффективности фармакологической и электрической кардиоверсии.
Вышеописанные функциональные и структурные изменения миокарда предсердий в сочетании с нарушением реологии крови, особенно стазом форменных элементов в области ушка левого предсердия (УЛП), способствуют формированию гиперкоагуляционной среды. Более того, даже короткие пароксизмы ФП приводят к повреждению миокарда предсердий и экспрессии протромботических факторов на эндокардиальной поверхности наряду с активацией тромбоцитов и клеток воспаления, что также вносит вклад в поддержание генерализованной гиперкоагуляции. Данная теория системной и локальной предсердной активации коагуляционной системы частично объясняет факт наличия долгосрочного риска развития инсульта даже на фоне недлительных эпизодов ФП.
Генетическая предрасположенность к фибрилляции предсердий
ФП, особенно при дебюте в раннем возрасте, во многом является генетически обусловленной патологией, причем независимо от сопутствующих сердечно-сосудистых заболеваний. Небольшая доля молодых пациентов с ФП также имеет наследственные кардиомиопатии или каналопатии, которые являются следствием врожденных патологических мутаций. Данные моногенные заболевания ассоциируются с повышенным риском внезапной смерти. Примерно у трети пациентов с ФП выявляются распространенные генетические полиморфизмы, предрасполагающие к возникновению аритмии, несмотря на относительно низкий дополнительный риск. На данный момент известно около 14 вариантов изменений в генотипе, приводящих к нарушению ритма. Считается, что самая частая и значимая мутация располагается на хромосоме 4q25. В этой ситуации возникает комплексное нарушение структур и функций миокарда предсердий – происходит его ремоделирование. Наличие данных генетических полиморфизмов повышает риск развития ФП по меньшей мере в семь раз. Поэтому геномный анализ в будущем может стать полезным для диагностики и выбора оптимальной стратегии контроля ритма или ЧСС при ФП. А также позволит улучшить прогноз заболевания и снизить инвалидность благодаря ранней диагностике патологии и вовремя начатому лечению.
Электрофизиологические механизмы ФП
Итак, для возникновения устойчивых ФП и ТП необходимо наличие трех составляющих: 1) пусковых, т. н. триггерных факторов аритмии, 2) аритмогенного субстрата аритмии, обеспечивающего самостоятельное поддержание аритмии, а также 3) индивидуальных модулирующих влияний, повышающих восприимчивость аритмогенного субстрата к триггерным факторам. В подавляющем большинстве случаев (95%) триггерным фактором ФП является патологическая высокочастотная электрическая активность в устьях легочных вен, отражением которой на ЭКГ является частая ранняя предсердная экстрасистолия (по типу "Р на Т", и/или пробежки предсердной тахикардии (как монофокусной, так и хаотической). Более редкими триггерными факторами ФП являются экстрасистолы из полых вен, а также предсердные экстрасистолы. Электрофизиологическими механизмами очаговой активности легочных и полых вен является триггерная активность и повторный вход возбуждения (re-entry) в мышечных структурах, выстилающих места их впадений в предсердия. При проведении ЭФИ приступы ФП и, особенно, ТП могут быть вызваны электростимуляцией предсердий.
Для возникновения ТП также требуется предсердная экстрасистолия, однако у пациентов с отсутствием сочетанной ФП триггеры обычно локализуются вне легочных вен. Аритмогенный субстрат ТП представляет из себя цепь макро-реэнтри (протяженную петлю циркуляции возбуждения) в правом и/или левом предсердиях, возникшую вследствие нарушения процессов проведения электрического возбуждения по предсердному миокарду. Критическими компонентами цепи макро-реэнтри ТП являются наличие протяженного анатомического барьера, вокруг которого возможна циркуляция импульсов, а также зоны замедленного проведения в одном или нескольких участков этой цепи, позволяющей фронту волны возбуждения замедлять ход и не наталкиваться на рефрактерный участок предсердий, следующей за хвостовой частью волны ре-энтри.
Аритмогенный субстрат ФП представляет собой структурно и функционально измененный (ремоделированный) миокард предсердий, обеспечивающий стойкое самостоятельное поддержание хаотической электрической активности предсердий. Под ремоделированием понимают совокупность патологических процессов, возникающих в предсердиях в ответ на возникновение ФП или/и в результате действия известных этиологических факторов. Ремоделирование начинается с нарушения ионных клеточных механизмов формирования импульса и заканчивается структурно-функциональной деградацией предсердного миокарда и атриомегалией. Функциональные нарушения в предсердном миокарде включают в себя возникновение неоднородности скоростей проведения импульсов в разных направлениях, а также дисперсию процессов реполяризации в предсердном миокарде. Прогрессирование ФП и резистентность аритмии к лекарственному и интервенционному лечению, как правило, определяется выраженностью процессов ремоделирования предсердий. В настоящее время рассматриваются две альтернативные электрофизиологические гипотезы самоподдержания ФП: 1) наличие одного или нескольких высокочастотных роторов в предсердиях или легочных венах с постоянно меняющимся характером проведения импульсов на окружающий миокард предсердий; 2) циркуляция множественных волн микро-реэнтри в предсердиях по неопределенному, случайному пути.
Наиболее частым модулирующим влиянием, способствующим активации "спящего" аритмогенных субстратов ФП и ТП в ответ на действие триггерного фактора, является дисбаланс вегетативных влияний на миокард предсердий. В зависимости от характера нарушений автономной регуляции работы сердца выделяют т. н. "вагусную" форму мерцательной аритмии (аритмия возникает преимущественно во время сна или после переедания, при резких наклонах или поворотах туловища, а также любых других факторах, усиливающих парасимпатические влияния на сердце), а также т. н. "гиперадренергическую" форму мерцательной аритмии (ФП/ТП возникают преимущественно в момент физической нагрузки, при стрессе, резком испуге и других состояниях, сопровождающихся повышением симпатических влияний на сердце). В качестве других модулирующих влияний могут выступать нарушения электролитного обмена (гипокалиемия), преходящая ишемия миокарда и проаритмическое действие лекарственных препаратов.
Таким образом, фибрилляция предсердий является частым сердечно-сосудистым заболеванием, которое имеет сложные патогенетические механизмы. Знание механизмов развития данного вида аритмии позволяет подобрать наиболее эффективное лечение.
16 октября 2019 г.
Ещё больше полезной информации на нашем Телеграм-канале