Мультивисцеральная резекция при местнораспространенном раке желудка. Клиническое наблюдение.
Евсеев М.А., Владыкин А.Л., Подберезина Ю.Л., Зингеренко В.Б., Куринный В.А.
Multivisceral resection for advanced gastric cancer. Case report.
Evseev M.A., Vladykin A.L., Podberezina Y.L., Zingerenko V.B., Kurinny V.A.
Необходимость и возможность проведения мультивисцеральных резекций при местнораспространенных формах злокачественных новообразований в абдоминальной онкохирургии является предметом перманентного обсуждения на протяжении нескольких десятилетий. При этом обсуждаются не только и не столько технические нюансы выполнения оперативных вмешательств большого и сверхбольшого объема, сколько реальная переносимость пациентами данных операций и их целесообразность с точки зрения отдаленных результатов. При этом если мультивисцеральные резекции при злокачественных новообразованиях толстой кишки и органов малого таза к настоящему времени рассматриваются уже как стандартный вариант оперативного пособия, то проведение расширенных операций при местнораспространенных опухолях желудка по-прежнему вызывает целый ряд вопросов. Это, в свою очередь, связано как с особенностями злокачественных новообразований желудка (быстрое местное прогрессирование опухолевого процесса и его генерализация, сомнительная эффективность неоадъювантной и адъювантной терапии), так и с топографо-анатомическими особенностями расположения самого желудка, определяющими возможность опухолевой инвазии печени, поджелудочной железы, двенадцатиперстной кишки, ободочной кишки, магистральных сосудов верхнего этажа брюшной полости. Данные обстоятельства, сами по себе диктующие необходимость выполнения мультивисцеральных резекций (естественно с регионарной лимфаденэктомией > D2) при весьма часто встречающемся сейчас местнораспространенном раке желудка, безусловно, весьма важны для принятия решения о необходимости выполнения данному конкретному пациенту операции с радикальностью R0. С другой стороны очевидны факторы, лимитирующие возможность проведения операций в объемах, равных или превышающих гастрэктомию с панкреатодуоденальной резекцией: адекватное анестезиологическое и реанимационное пособие при высоком риске интра- и послеоперационных осложнений, технологии бескровной хирургии и замещения острой кровопотери. При этом интегральный показатель общесоматического статуса пациента в сочетании с указанными факторами объективно определяют крайне высокую степень операционно-анестезиологического риска и в подавляющем большинстве случаев являются на сегодняшний день аргументированным основанием для отказа от радикальной операции. Аналогично весьма ограниченный объем наблюдений отдаленных результатов после мультивисцеральных резекций, имеющих своей составной частью гастрэктомию, не позволяет большинству авторов высказывать однозначные суждения о целесообразности данных вмешательств в плане увеличения трех- и пятилетней выживаемости пациентов.
Xin-Bao Wang et al. (2008) сообщают о 17 случаях тотальной гастрэктомии с ПДР, выполненнных в группе их 53 пациентов с синхронным опухолевым поражением желудка и панкреатодуоденального комплекса за 9-летний период. 3- и 5-летняя выживаемость после мультивисцеральной резекции составила 77 и 34% соответственно, в 59% случаев отмечалось локальное прогрессирование процесса. Авторы указывают, что предикторами удовлетворительных отдаленных результатов являются высокая степень дифференцировки аденокарциномы и радикальность проведенной операции R0.
P.Roberts et al. (2012), проведя анализ баз данных Medline, EMBASE и Cochrane database, сообщают всего о 27 выполненных тотальных гастрэктомиях в сочетании с панкреатодуоденальной резекцией за период с 1985 по 2009 год. В подавляющем большинстве случаев оперативные вмешательства проводились пациентам с Т-критерием Т3 и Т4. При этом выявленная до операции или интраоперационно IVстадия онкопроцесса не являлась причиной отказа от мультивисцеральной резекции. Показанием для проведения панкреатодуоденальной резекции (ПДР) при раке желудка служили распространение опухоли дистальнее привратника, инвазия опухоли в головку поджелудочной железы, метастатическое поражение лимфоузлов в области головки поджелудочной железы. Неоадъювантная химио- и лучевая терапия проводилась в ограниченном числе наблюдений, не имела систематического характера и ее результаты не могут быть подвергнуты статистическому анализу. Авторы указывают, что комбинация гастрэктомии с ПДР достоверно увеличивает число послеоперационных осложнений (23,1 – 73,9%) по сравнению с гастрэктомией в моноварианте (3,2 – 31,9%). При этом ни об одном летальном исходе после мультивисцеральной резекции авторы не сообщают. Анализируя отдаленные результаты оперативных вмешательств, авторы указывают, что хотя в ряде сообщений достоверные различия в 5-летней выживаемости отсутствуют, все же имеется тренд увеличения 3- и 5-летней выживаемости у пациентов после мультивисцеральных резекций по сравнению с только гастрэктомией вследствие очевидно меньшего числа R1 резекций у пациентов первой группы.
О.И. Кит и соавт. (2013) приводят данные о 22 тотальных гастрэктомиях в сочетании с ПДР за период с 1983 по 2010 год. Мультивисцеральные резекции сопровождались развитием осложнений раннего послеоперационного периода у 73,3% пациентов и 2 летальными исходами. В последующем 5 пациентам потребовалась проведение отсроченных реконструктивных операций. Авторы указывают, что ПДР в сочетании с гастрэктомией, выполняемые по поводу распространенного рака желудка, повышают радикализм операции, что находит свое отражение в увеличении 3-летней выживаемости у этих пациентов. Авторы подчеркивают, что на современном этапе освоения техники ПДР ее сочетание с гастрэктомией в руках опытного хирурга-онколога при адекватном анестезиологическом пособии и послеоперационной реабилитации является приемлемым методом лечения пациентов с местнораспространенным раком желудка без метастазов в регионарные лимфоузлы.
В монографии «Комбинированные операции при раке желудка», вышедшей в 2005 году под редакцией В.Ф. Касаткина, указываются причины действительно единичных наблюдений сочетания гастрэктомии с ПДР: значительная операционная травма, длительность оперативного вмешательства и наркоза, удаление обширного препарата с образованием «дефицита объема тканей» в брюшной полости, отсутствие большого сальника как пластического материала и «биологического» тампона, необходимость формирования двух опасных в плане развития несостоятельности соустий (панкреатического и пищеводного). Указанные обстоятельства являются закономерной причиной осложненного течения послеоперационного периода практически у 80% пациентов. Авторы приводят сведения о двух случаях расширения объема мультивисцеральной резекции до сочетания гастрэктомии и ПДР с правосторонней гемиколэктомией, а также приводят данные о выполненной в 2000 году А.Ф. Черноусовым сочетанную с гастрэктомией и ПДР резекцию поперечно-ободочной кишки. При этом целесообразность выполнения операций подобного объема аргументируется авторами монографии достаточно эмоционально: « Сознавая высокий риск летального исхода, опирались на мысль об улучшении состояния больного и на призрачную надежду выздоровления. Опорой являлся тот факт, что большинство оперированных были доведены своим недугом до полного отчаяния и, понимая, что единственным реальным шансом для продления жизни является операция, буквально требовали хирургического вмешательства».
Выполняя оперативные вмешательства по поводу рака желудка в нашей Клинике мы весьма нередко сталкиваемся с необходимостью расширения объема операции до сочетания субтотальной резекции или гастрэктомии с резекцией хвоста или корпорокаудальной резекцией поджелудочной железы, резекцией поперечно-ободочной кишки, атипичной или анатомической резекцией сегментов печени. Однако с необходимостью выполнения мультивисцеральной резекции в объеме гастрэктомии, ПДР и расширенной правосторонней гемиколэктомии мы столкнулись впервые. Учитывая упомянутое выше малое число наблюдений операций такого объема, имеющихся в литературе, мы сочли возможным описание данного клинического случая.
Пациентка N. , 39 лет, мать троих детей, жительница районного центра ЦФО, обратилась 07.12.2016 за консультативной помощью в Отделение абдоминальной хирургии ФГБУ Клиническая больница №1 (Волынская) УДП РФ с жалобами на невозможность употребления твердой пищи, практически постоянное ощущение переполнения в эпигастрии, срыгивание и периодическую рвоту съеденной пищей. Указанные симптомы впервые были отмечены пациенткой в июле 2016 года. При амбулаторном и госпитальном обследовании в условиях хирургического (!) отделения ЦРБ по месту жительства в сентябре 2016 года в ходе эзофагогастродуоденоскопии была выявлена «деформация и рубцово-язвенный стеноз пилоро-бульбарной зоны», взята биопсия. Гистологическое исследование биоптата оказалось неинформативным. Пациентка была выписана для амбулаторного проведения противоязвенной терапии с рекомендациями консультации у онколога головного медицинского учреждения региона по поводу «susp. Bl. желудка(?)». Рекомендованная консультация онколога проведена не была. Лишь вследствие нарастающих явлений нарушения эвакуации желудочного содержимого пациентка в ноябре 2016 года вновь обратилась за амбулаторной помощью к врачу-гастроэнтерологу по месту жительства. Врач-гастроэнтеролог расценил клиническую картину как «проявления хеликобактериоза и дисбактериоза кишечника», назначив эрадикационную терапию. В плане дообследования пациентке была амбулаторно выполнена рентгеноскопия желудка с контрастированием, при которой диагностирован суб- декомпенсированный стеноз пилоробульбарной зоны без уточнения его этиологии. С конца ноября 2016 года пациентка отмечала появление слабости, задержку стула в течение 2 – 4 суток, периодически появление стула черного цвета. Пациентка указывала на факт суммарной потери массы за 4 месяца на 10 кг. В анамнезе у пациентки имеются три кесарева сечения, последнее – с перевязкой маточных труб.
При осмотре состояние пациентки было расценено как среднетяжелое. Пациентка нормостенического телосложения, ИМТ 22,9. Клинически значимых нарушений общесоматического статуса, в том числе периферической лимфаденопатии, выявлено не было. Обращало на себя внимание наличие пальпируемого ограниченно смещаемого безболезненного объемного образования в эпигастральной области. При ректальном пальцевом исследовании выявлены следы кала черного цвета.
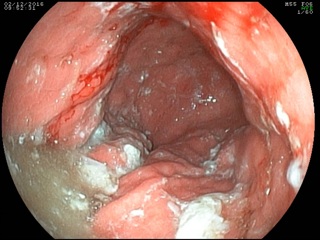
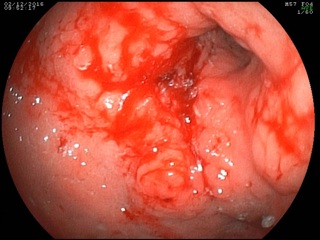
При срочной ЭГДС выявлена циркулярная опухолевая инфильтрация антрального отдела с распространением проксимально по малой кривизне на 2 см выше угла желудка, дистально – на луковицу двенадцатиперстный кишки и постбульбарный отдел, с изъязвлением в антральном отделе 2 х 2,5 см, в дне которого определяется налет солянокислого гематина; многофокусная биопсия. Гистологическое исследование эндоскопического биоптата: низкодифференцированная аденокарцинома с наличием перстневидных клеток.
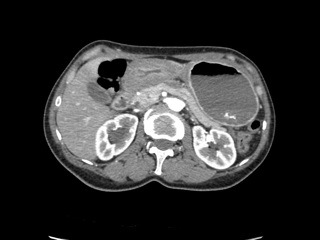
08.12.2016 пациентка была госпитализирована в отделение абдоминальной хирургии ФГБУ Клиническая больница №1 (Волынская) УДП РФ. На момент госпитализации лабораторные показатели находились в пределах физиологической нормы (в том числе Hb 128 г/л, Лц 7,6, СОЭ 21 мм/ч, общий белок 66 г/л). При проведении МСКТ с болюсным контрастированием выявлено: верхний отдел желудка растянут содержимым, в котором выявляется гиперденсивная взвесь (вероятно, остатки бария); стенки антрального отдела утолщены до 15мм, вокруг антрального отдела имеются количественно увеличенные лимфоузлы размерами 9-12мм, пилорический отдел без четких границ сливается с луковицей 12-перстной кишки, просвет в нем не прослеживается; толщина стенок луковицы и постбульбарного отдела 7мм, на остальном протяжении стенки кишки не утолщены; стенки желудка и 12-перстной кишки, прилежащие к головке поджелудочной железы без убедительных признаков инвазии; селезенка не увеличена, однородна; поджелудочная железа с четкими контурами, не увеличена, однородной структуры; панкреатический проток не расширен; участков патологического накопления контрастного вещества паренхимой железы не выявлено; печень не увеличена, однородной структуры; внутри- и внепеченочные желчные протоки не расширены, желчный пузырь обычных размеров, тонкостенный, в просвете – однородное жидкое содержимое; признаки стеноза н/3 правого мочеточника; выраженная уретеропиелокаликоэктазия справа; жидкости в брюшной полости нет. При МСКТ грудной клетки патологических изменений не выявлено.
С учетом верифицированного гистологически опухолевого поражения желудка, осложненного декомпенсированным стенозом и рецидивирующими кровотечениями, при отсутствии признаков системной диссеминации опухолевого процесса и признаков нерезектабельности опухоли принято решение о необходимости проведения оперативного вмешательства в объеме дистальной субтотальной резекции желудка с панкреатодуоденальной резекцией по жизненным показаниям.
В течение 4 суток пациентке проводилась предоперационная подготовка, включавшая парентеральное введение смесей «три в одном», инфузии полиионных растворов и сипинга официнальными питательными смесями с общим калоражем до 2800 ккал/сут. В связи со стриктурой правого мочеточника произведена установка внутреннего мочеточникового стента справа.
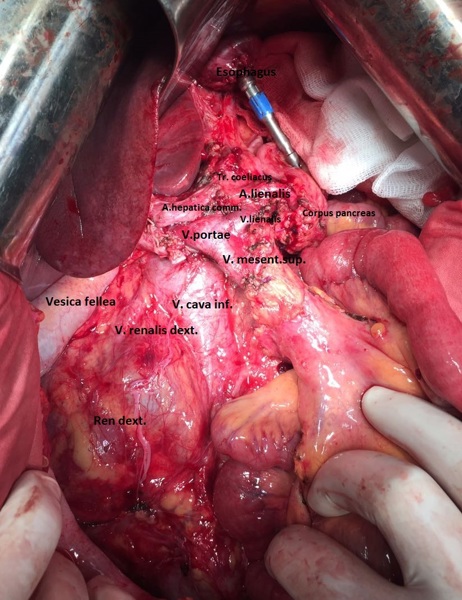
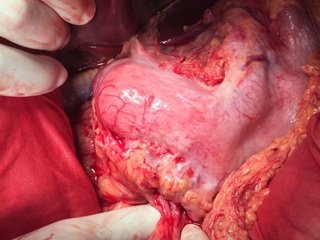
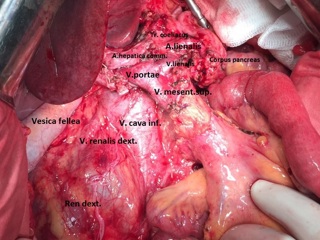
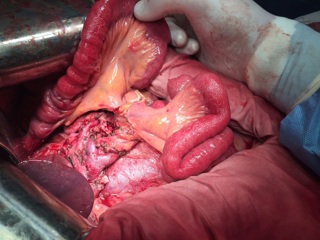
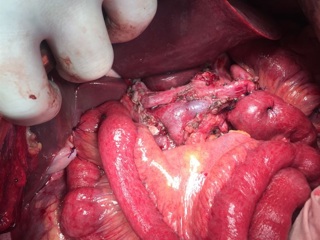
13.12.2016 пациентка оперирована под эндотрахеальным наркозом в комбинации с эпидуральной анестезией. На этапе интраоперационной ревизии выявлена инвазирующая серозу передней и задней стенок желудка циркулярная опухоль антрального отдела, распространяющаяся проксимально на тело желудка и субкардию по малой кривизне, дистально – на луковицу двенадцатиперстной кишки и постбульбарный отдел. Установлена инвазия опухоли по задней стенке антрального отдела в головку поджелудочной железы, мезоколон справа и слева от средних ободочных сосудов, в стенку поперечно-ободочной кишки в области печеночного изгиба. Кроме того определялись инфильтрация правого параколического пространства, наличие характерных очагов диссеминации на висцеральной брюшине илио-цекального угла и в проекции дистальной части нижней брыжеечной вены. Определялось макроскопическое увеличение лимфоузлов групп 3, 4d, 5, 6, 7, 15 (по JCGC).
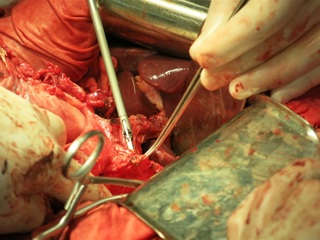
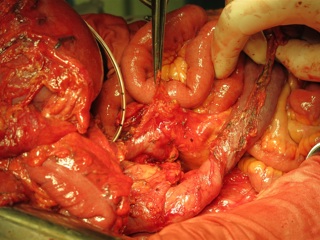
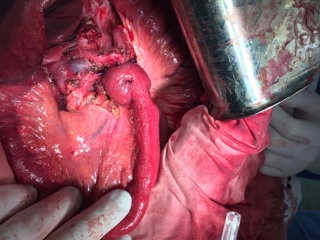
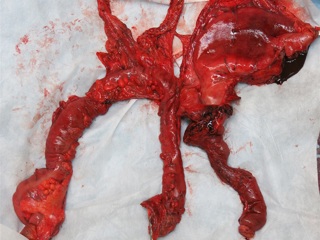
С учетом данных операционной находки объем операции был расширен до гастрэктомии, панкреатодуоденальной резекции, расширенной правосторонней гемиколэктомии с регионарной лимфаденэктомией D2. Во время резекционного этапа пищевод пересечен на 2 см выше кардии, тощая кишка – на 10 см дистальнее додено-еюнального перехода; поджелудочная железа пересечена на границе перешейка и тела; подвздошная кишка пересечена на 15 см проксимальнее илио-цекального угла, ободочная кишка – на 4 см дистальнее селезеночного изгиба; холедох пересечен на 0,5 см дистальнее впадения пузырного протока; подвздошно-ободочная и средняя ободочная артерии лигированы у места отхождения от верхней брыжеечной артерии, одноименные вены – у места впадения в верхнюю брыжеечную вену. Нижняя брыжеечная вена после пробного пережатия пересечена в 4 см от места впадения в селезеночную вену. Выполнена регионарная лимфаденэктомия с удалением лимфоузлов групп 1 – 12, 13, 14v, 15, 16b1 (по JCGC). Препарат удален единым блоком. Диссекция тканей в ходе резекционного этапа проводилась с использованием аппаратов Thunderbeat и TriadeForce в режиме Valleylab. При срочном гистологическом исследовании в краях резекции опухолевого роста не обнаружено.
Реконструктивный этап вмешательства выполнен с формированием алиментарной и билиопанкреатической (70 см) петель тонкой кишки по Ру. На алиментарной петле произведено формирование эзофаго-энтероанастомоза «конец в конец» циркулярным сшивающим аппаратом Covidien EEA28, илио-десцендоанастомоза «бок в бок» аппаратом Covidien EndoGIA 60. Алиментарная и билиопанкреатические петли соединены межкишечным анастомозом «бок в бок» аппаратом Covidien EndoGIA 60, сформированным дистальнее эзофагоэнтероанастомоза на 45 см. На билиопанкреатическорй петле произведено формирование инвагинационного панкреато-энтероанастомоза «конец в конец» одиночными швами Maxon 3/0 по методике, описанной J.L. Cameron et al. (2006). Данная методика формирования анастомоза была избрана вследствие малого диаметра вирсунгова протока (до 1,5 мм), отсутствия фиброза паренхимы и невыраженной капсулы поджелудочной железы. В 20 см дистальнее данного анастомоза был сформирован холецисто-энтероанастомоз однорядным непрерывным швом Biosyn 3/0. Дополнительно на билиопанкреатической петле сформирован брауновский анастомоз «бок в бок» аппаратом Covidien EndoGIA 45. В алиментарную петлю за зону эзофаго-энтероанастомоза и Ру-анастомоза проведен трансназальный питательный зонд. Оперативное вмешательство завершено дренированием подпеченочного, левого поддиафрагмального пространства, полости малого таза и зоны панкреато-энтероанастомоза. Продолжительность оперативного вмешательства – 7ч.30 минут. Общий объем интраоперационной кровопотери с учетом удаленного препарата – до 1 литра.
В первые 72 часа послеоперационного периода пациентка наблюдалась в условиях отделения хирургической реанимации. Переведена на самостоятельное дыхание через 1 час после окончания операции. Через 12 часов с момента окончания операции начата инфузия полуэлементных смесей в питательный зонд, парентеральная нутритивная поддержка смесью «три в одном». Через 24 часа от момента окончания операции пациентка переведена на зондовое питание стандартной смесью. Питательный зонд удален через 48 часов от момента окончания операции, пациентка получала комбинированную парентерально-энтеральную поддержку с сипингом высококалорийных смесей на фоне посиндромного лечения, антибактериальной терапии, инфузии октреотида 0,025 мг/час, тромбопрофилактики НМГ. С этого же момента началась физическая активизация больной (присаживание в кровати, подъем на ноги). Аускультативно перистальтические шумы начали определяться спустя 24 часа после окончания операции, отхождение газов началось через 48 часов, стул – на 3 сутки послеоперационного периода.
С 4 суток послеоперационного периода послеоперационная реабилитация проводилась в условиях отделения абдоминальной хирургии. На фоне проводимой комбинированной парентерально-энтеральной нутритивной поддержи рацион был расширен пероральным приемом кисломолочных продуктов, бульонов. В течение 3 – 6 суток отмечался многократный жидкий стул, периодические спастические боли в животе, явления метеоризма. Однако уже к 10 суткам послеоперационного периода указанные явления нивелировались, стул приобрел оформленный характер, имел место один раз в сутки. Отделяемое по дренажам, начиная с 1 суток послеоперационного периода, имело серозный характер, составляя суммарно до 100 мл в сутки и ограничившись к 6 суткам послеоперационного периода до 50 мл. Дренажи из малого таза и левого поддиафрагмального пространства были удалены на 6 сутки послеоперационного периода, дренаж из подпеченочного пространства – на 7 сутки. На 9 сутки послеоперационного периода на фоне подкожных инъекций октреотида 0,3 мг/сут отмечено поступление прозрачного бесцветного отделяемого из дренажа, установленного в области панкреато-энтероанастомоза в количестве до 50 – 100 мл в сутки (амилаза 9100 МЕ). При контрольных УЗИ брюшной полости на 3, 6, 9 и 13 сутки послеоперационного периода скоплений жидкости в брюшной полости и в забрюшинном пространстве не выявлено. Пациентка полностью перешла на прием жидкой части 1 стола в стандартном суточном объеме.
В лабораторных показателях в динамике отмечались умеренная анемия до 95 г/л, лейкоцитоз до 13,4, гиперамилаземия до 340 МЕ, гипопротеинемия до 47 г/л на 2-4 сутки послеоперационного периода. Эпизодов гипертермии за весь период послеоперационного наблюдения не отмечалось. На 13 сутки послеоперационного периода уровень гемоглобина составил 103 г/л, лейкоцитов – 7,7, амилазы - 76 МЕ, общего белка - 63 г/л.
Учитывая отсутствие признаков инфекционных осложнений, относительную нормализацию функции пищеварительного тракта, но сохраняющееся при этом дебит панкреатического сока в 50-70 мл/сут, было принято решение выписать пациентку для продолжения амбулаторной реабилитации с функционирующим дренажом на 14-сутки послеоперационного периода. Контрольное обследование пациентки и решение вопроса о возможности удаления дренажа запланировано через 14 суток амбулаторной реабилитации.
При гистологическом исследовании операционного препарата: в стенке желудка - разрастание опухоли, имеющей строение низкодифференцированной аденокарциномы с наличием перстневидных клеток. Опухоль прорастает в подслизистый и мышечный слои, в субсерозный и серозный слой, врастает в малый сальник, поперечно-ободочную кишку, растет по фиброзным прослойкам в толще жировой клетчатки. Большое количество опухолевых клеток определяется в периневральных пространствах и сосудистых щелях. Элементы опухоли обнаружены в ткани головки поджелудочной железы, мышечном и подслизистом слое слепой кишки и червеобразного отростка, стенке 12-перстной кишки, мезоколон, параколической клетчатке. Обнаружены метастазы опухоли в 7 из 24 исследованных лимфоузлов. В краях резекции желудка, тощей кишки, подвздошной кишки, ободочной кишки опухолевого роста не выявлено. Проводится иммуногистохимическое исследование.
Заключительный диагноз сформулирован следующим образом: Рак антрального отдела и тела желудка fT4N3M1(PER) тип III Borrmann с распространением на двенадцатиперстную кишку и субкардию, инвазией головки поджелудочной железы, мезоколон, поперечно-ободочной кишки, правого параколон. Декомпенсированный опухолевый стеноз пилоробульбарной зоны, рецидивирующее желудочное кровотечение. Посттравматическая рубцовая стриктура нижней трети правого мочеточника, уретерогидронефроз справа. В перспективе у пациентки – проведение адъювантной полихимиотерапии (с учетом данных ИГХ), рассмотрение вопроса о целесообразности проведения радиофармтерапии.
Заключая описание вышеприведенного клинического случая, считаем необходимым привести ряд комментариев. Безусловно, проведенное хирургическое лечение пациентки относится не только и не столько к разряду нестандартных и редко производимых операций. Скорее подобную операцию следует отнести к разряду операций отчаяния, продиктованных вполне объяснимой мотивацией спасти или хотя бы продлить жизнь пациентки при наличии не только формальных показаний в виде декомпенсированного стеноза и рецидивирующего кровотечения из опухоли, но и мотивацией, обусловленной целым рядом социальных факторов. В ходе вмешательства, определив всю обширность и распространенность опухолевого поражения, мы прекрасно осознавали всю призрачность наших надежд на выполнение абсолютно радикального оперативного вмешательства. И в то же время решение об ограничении объема операции наложением обходных анастомозов, лишающее пациентку всяких шансов на жизнь более 2-3 месяцев, коллегиально было признано неприемлемым. Тем более, что на факт запущенности онкопроцесса и очевидно запоздалое оперативное вмешательство, оказал влияние не только сам по себе агрессивный тип опухоли (см. анамнез). При этом, в полной мере учитывая высокую степень риска возникновения интра- и послеоперационных осложнений, мы все же рассчитывали на благоприятный исход операции, принимая во внимание целый ряд очевидно присутствовавших позитивных факторов, а именно: молодой возраст и удовлетворительный общесоматический статус пациентки, отсутствие признаков субклинической органной недостаточности и значимых нарушений гомеостаза, материальный ресурс операционной, включающий применение в том числе кровесберегающих технологий, возможности анестезиолого-реанимационного обеспечения операции и раннего послеоперационного периода.
Мы привели лишь единичное клиническое наблюдение мультивисцеральной резеции при местнораспространенном раке желудка, однако полагаем, что оно может быть полезно как для продолжения дискуссии о необходимости и возможности операций подобного объема, так и для принятия решения, крайне непростого с медицинской и общечеловеческой точек зрения, в конкретной клинической ситуации.
Литература:
- Комбинированные операции при раке желудка. Под ред. В.Ф. Касаткина. 2005.
- Kit OI, Kasatkin VF, Maksimov AY, Trifanov VS. Gastrectomy in combination with pancreatoduodenal resection for gastric cancer. The journal «ONCOSURGERY» 2013, Vol.5, No 1.
- Otsuji E, Yamaguchi T, et al. Total gastrectomy with simultaneous pancreaticosplenectomy or splenectomy in patients with advanced gastic carcinoma. Br J Cancer. 1999; 79: 1789–1793.
- Roberts P. , Seevaratnam R., Cardoso R. Systematic review of pancreaticoduodenectomy for locally advanced gastric cancer. Gastric Cancer (2012) 15 (Suppl 1):S108–S115.
- Xin-Bao Wang, Li-Tao Yang, Ze-Wei Zhang. Pancreaticoduodenectomy for advanced gastric cancer with pancreaticoduodenal region involvement. World J Gastroenterol 2008 June 7; 14(21): 3425-3429.
- Zhang M, Zhang H, Ma Y, Zhu G, Xue Y. Prognosis and surgical treatment of gastric cancer invading adjacent organs. ANZ J Surg. 2010;80(7–8):510–4.
- Ozer I, Bostanci EB, Orug T, Ozogul YB, Ulas M, Ercan M, et al. Surgical outcomes and survival after multiorgan resection for locally advanced gastric cancer. Am J Surg. 2009;198(1):25–30.
27 декабря 2016 г.
Ещё больше полезной информации на нашем Телеграм-канале